Unidad III
Masa atómica
Masa de un átomo correspondiente a un determinado
elemento químico. Se suele utilizar la uma como unidad de medida. Donde
u.m.a son siglas que significan "unidad de masa atómica".
Las masas atómicas de los elementos químicos se suelen
calcular con la media ponderada de las masas de los distintos isótopos de cada
elemento teniendo en cuenta la abundancia relativa de cada uno de ellos, lo que
explica la no correspondencia entre la masa atómica en umas, de un elemento, y
el número de nucleones que alberga el núcleo de su isótopo más común.
Masa atómica(m. a.), es la suma de sus protones y neutrones y varía en los distintos elementos de la tabla periódica.
Masa molecular
Cuando los átomos forman moléculas, los átomos se unen y el
peso de la molécula es el peso combinado de todas sus partes.
La masa molecular es la masa de una molécula de un
compuesto. Se mide en unidades de masa atómica, representada como UMA.
Se calcula sumando las
masas atómicas de los elementos que componen la molécula. Así, en el caso
del
agua: H2O, su masa molecular es:
H=2 x 1,00007 + O=
15.9999 = 16 u (Uma)
La masa molar coincide numéricamente con la masa
molecular, pero son dos cosas distintas.
Mientras que la masa molecular es la masa de una molécula,
la masa molar es la masa de un mol de compuesto, es decir, del número de
Avogadro de moléculas. La masa molecular en u coincide numéricamente con la
masa molar en gramos.
Mol
Un átomo es una cantidad de sustancia extraordinariamente pequeña. De igual modo, una molécula, que es un conjunto de pocos (a veces no tan pocos) átomos, es también una cantidad de sustancia muy pequeña. Para manejarnos en la práctica es necesario definir una unidad mucho mayor que represente una cantidad de sustancia del orden del gramo. Esta unidad es el mol, que ha sido aceptada en 1971 como una de las siete unidades fundamentales del Sistema Internacional. Es la unidad que corresponde a la magnitud cantidad de sustancia.
Un mol de átomos es la cantidad de un elemento químico que contiene tantos átomos como hay en 0,012 kg de carbono-12. La masa de un mol de átomos equivale a su masa atómica relativa expresada en gramos. Mientras que un mol de un compuesto es la cantidad de ese compuesto equivalente a su masa molecular relativa expresada en gramos.
Ba(NO3)2 --> 261,34 g NaNO3 --> 85 g KMnO4 --> 158 g
Un átomo es una cantidad de sustancia extraordinariamente pequeña. De igual modo, una molécula, que es un conjunto de pocos (a veces no tan pocos) átomos, es también una cantidad de sustancia muy pequeña. Para manejarnos en la práctica es necesario definir una unidad mucho mayor que represente una cantidad de sustancia del orden del gramo. Esta unidad es el mol, que ha sido aceptada en 1971 como una de las siete unidades fundamentales del Sistema Internacional. Es la unidad que corresponde a la magnitud cantidad de sustancia.
Un mol de átomos es la cantidad de un elemento químico que contiene tantos átomos como hay en 0,012 kg de carbono-12. La masa de un mol de átomos equivale a su masa atómica relativa expresada en gramos. Mientras que un mol de un compuesto es la cantidad de ese compuesto equivalente a su masa molecular relativa expresada en gramos.
Ba(NO3)2 --> 261,34 g NaNO3 --> 85 g KMnO4 --> 158 g
Un mol es la cantidad
de materia que contiene 6,02 x 1023 partículas elementales (ya sea átomos,
moléculas, iones,
partículas subatómicas, etcétera) en 12
gramos de Carbono. También se llama
Número de Avogadro. Por ejemplo, una mol de etanol es igual a 6.023 × 10 23 moléculas de etanol.
Hipótesis de avogrado
En 1811, Amadeo Avogadro (1776–1856) relacionó la teoría de Dalton y las experiencias de Gay
Lussac al proponer las dos hipótesis siguientes:
• Las últimas partículas de los gases elementales no son átomos individuales sino agregados de dos átomos (moléculas). Hidrógeno, oxígeno y nitrógeno, entre otros, son gases diatómicos.
• Volúmenes iguales de todos los gases, bajo las mismas condiciones de presión y temperatura, contienen un número idéntico de moléculas.
• Las últimas partículas de los gases elementales no son átomos individuales sino agregados de dos átomos (moléculas). Hidrógeno, oxígeno y nitrógeno, entre otros, son gases diatómicos.
• Volúmenes iguales de todos los gases, bajo las mismas condiciones de presión y temperatura, contienen un número idéntico de moléculas.
El principio de Avogadro permitió establecer el concepto de átomo y molécula: un átomo es la parte
más pequeña de un elemento químico y una molécula es la parte más pequeña, con existencia
individual estable, de una sustancia pura.
Las moléculas se diferencian unas de otras por el número y el tipo de átomos que las forman, así
como por la manera en que dichos átomos están dispuestos. Una sustancia pura está formada por un
solo tipo de moléculas y estas son iguales entre sí.
Numero de avogrado
En 1811, el químico italiano Amadeo Avogadro determinó de forma experimental
que en 1 mol hay 6,022 ∙ 1023 partículas. En su honor se le denomina
número de Avogadro (NA). Basándose en las experiencias de Joseph-Louis
Gay-Lussac (1778-1850) con los gases, Avogadro llegó a determinar el número
de partículas en un mol.
En 1 mol de átomos hay el número de Avogadro de átomos (6,022 ∙ 1023 átomos).
Es decir, un mol es un número específico de material.
Los
átomos son demasiado pequeños para permitir medidas significativas de
sustancias químicas. Para trabajar con cantidades significativas de sustancias,
los científicos las agrupan en unidades llamadas moles. Un mol es definido como
el número de átomos de carbono en 12 gramos de un isótopo de carbón-12, el cual
es 602,2 sextillones
(6,022 por 10 a la potencia 23) de átomos. Este número es llamado número de
Avogadro o constante de Avogadro. Es usado como el número de átomos para
cualquier sustancia y la masa de 1 mol de una sustancia es su masa molar.
El número de Avogadro nos indica:
• El número de átomos que hay en un mol de átomos (átomo-gramo) de cualquier elemento.
• El número de moléculas que hay en un mol (molécula-gramo) de cualquier compuesto.
• El número de moléculas gaseosas contenidas en un mol (molécula-gramo) de cualquier gas a 0ºC y una atmósfera de presión.
• El número de átomos que hay en un mol de átomos (átomo-gramo) de cualquier elemento.
• El número de moléculas que hay en un mol (molécula-gramo) de cualquier compuesto.
• El número de moléculas gaseosas contenidas en un mol (molécula-gramo) de cualquier gas a 0ºC y una atmósfera de presión.
Masa molar de las sustancias
La masa molar se define como la masa de un mol de una sustancia. La masa
molar es una
característica física única, característica de cada sustancia pura.
En el campo de la química, la unidad
común usada para expresar la masa
molar es de gramos/mol. La masa molar de cualquier elemento es
numéricamente
igual a su masa atómica (expresada en uma) en la tabla periódica.
Los elementos tienen diferentes masas molares ya que los átomos de diferentes
elementos tienen
diferente número de protones, neutrones y electrones,
por tanto tienen diferentes masas atómicas.
Diferentes masas atómicas conducen
a diferentes masas molares.
Aquí se muestran algunos ejemplos de la
masa molar de algunos elemento:.
• La masa molar del carbono C es 12,0107 g/mol un mol de carbono tiene
aproximadamente 12 g de masa.
• La masa molar del potasio K es 39,0983 g/mol un mol de potasio tiene
aproximadamente 39 g de masa.
• La masa molar del oxígeno O es 15,9994 g/mol un mol de oxígeno tiene
aproximadamente 16 g de masa.
Para calcular la masa molar de un compuesto:
1.Encuentra
la
fórmula química para el compuesto. Este es el número de átomos de cada
elemento que forma el compuesto. Por ejemplo, la fórmula del cloruro de
hidrógeno
(ácido clorhídrico) es HCl
2.Encuentra
la
masa molar de cada elemento del compuesto. Multiplica la masa
atómica del elemento
por la constante de la masa por el número de átomos de ese elemento en el
compuesto. Así es como debes hacerlo: Para el cloruro de hidrógeno, HCl, la
masa molar de
cada elemento es 1,007 gramos por mol para el hidrógeno y 35,453
gramos por mol para el
cloruro.
3.Suma
las
masas molares de cada elemento en el compuesto. Esto determina la masa molar
de cada
compuesto. Así es como debes hacerlo: Para el cloruro de hidrógeno, la masa
molar es
1,007 + 35,453, o 36,460 gramos por mol.
Pasos para calcular moles:
1.Identifica
el
compuesto o elemento que debas convertir a moles.
2.Encuentra
el elemento en la tabla periódica.
3.Anota
el peso atómico del elemento.
Por lo general, éste es el número que se encuentra en la parte inferior, por
debajo del símbolo del
elemento. Por ejemplo, el peso atómico del helio es
4,0026. Si debes identificar la masa molar de un
compuesto, debes sumar todos
los pesos atómicos de cada elemento del compuesto.
4.Multiplica
el número de gramos del elemento/compuesto por la fracción 1/masa molar. Esto es
1 mol dividido por los
pesos atómicos que acabas de obtener. Puedes expresar esto como una fracción
del número de gramos por 1 mol dividido por la masa molar, o “compuesto g x
1/masa molar (g/mol)= moles”.
5.Divide
ese número por la masa molar.
El resultado es el número de moles de tu elemento o
compuesto. Por ejemplo,
imagina que tienes 2 g de agua, o H20, y quieres convertirlo a moles. La
masa
molar del agua es 18 g/mol. Multiplica 2 veces 1 para obtener 2. Divide 2 por
18, y tienes
0,1111 moles de H20.
6.Ejercicio:
Un recipiente
contiene 200 gramos de CO2.
Calcula el número de moles
Relaciones entre masa, mol, número de átomos, moléculas e iones
El mol es la unidad fundamental de la magnitud cantidad de sustancia que se relaciona con el resto de
magnitudes. En la siguiente figura se presenta la relación existente entre la masa de una sustancia
química y su número de átomos, moléculas e iones, través del concepto de mol.
Una ley fundamental de la química afirma que todo compuesto químico que esté formado por dos o
más elementos diferentes, cuenta con una cantidad o composición porcentual determinada de los
elementos que lo componen. Esto quiere decir que, por ejemplo, el Al(OH)3 que se obtiene en una
parte del mundo tiene el mismo porcentaje de aluminio, de oxígeno y de hidrógeno que el que se puede
obtener en cualquier otra parte del mundo.
Composición Porcentual
La composición porcentual de una sustancia es el porcentaje de masa de
cada elemento presente en un
compuesto: el 100% estará dado por la masa total del compuesto la cual recibe el nombre de masa
molar. La composición porcentual de cada elemento dentro de un compuesto es siempre la misma,
independientemente del tamaño de la muestra que se tome.
La composición porcentual se puede calcular si se conoce la fórmula del compuesto, mediante una
simple regla de tres, así:
compuesto: el 100% estará dado por la masa total del compuesto la cual recibe el nombre de masa
molar. La composición porcentual de cada elemento dentro de un compuesto es siempre la misma,
independientemente del tamaño de la muestra que se tome.
La composición porcentual se puede calcular si se conoce la fórmula del compuesto, mediante una
simple regla de tres, así:
% del elemento = (masa total del elemento /masa molecular) ∙ 100
Como se mencionó anteriormente, la masa del elemento presente en el
compuesto está dada por la
masa molar del elemento multiplicada por las
moles de átomos del elemento.
por ejemplo:
Para un mol de agua, se tiene 2 moles de átomos de hidrógeno y mol de
átomos de oxígeno. La masa
atómica del hidrógeno es 1 g y la del oxígeno
es 16 g. Por lo tanto, la masa molar del agua es 18 g.
Con este dato, la composición porcentual de cada elemento es la siguiente:
Porcentaje de H = 2 g/18 g∙ 100 = 11,11%
Porcentaje de O = 16 g/18 g ∙ 100 = 88,89%
Porcentaje de H = 2 g/18 g∙ 100 = 11,11%
Porcentaje de O = 16 g/18 g ∙ 100 = 88,89%
Calcule la composición porcentual Ni2(CO3)3
(carbonato de Níquel III)
1) Calculamos la masa molar del compuesto
Ni
|
2
x 58.69 =
|
117.38
|
C
|
3
x 12.01 =
|
36.03
|
O
|
9
x 16 =
|
144
+
|
297.41
g
|
2) Calculamos el porcentaje de cada
elemento.
%
O =
|
144
297.41 |
x
100
|
=
48.42 %
|
%
C =
|
36.03
297.41 |
x
100
|
=
12.11%
|
%
Ni =
|
117.38
297.41 |
x
100
|
=
39.47%
|
Una forma de comprobar si es correcta la
composición porcentual es sumar los porcentajes de
cada elemento. El total de
la suma debe ser igual a 100 o un
valor muy cercano. Para nuestro
ejemplo:
39.47
+
|
12.11
+
|
48.42
|
=
100
|
Formula empírica y molecular
Formula empírica
La palabra empírica siginifa que está basado en la observación y medida. Es
por ello que la fórmula
empírica de una sustancia es aquella que señala el
número relativo de átomos en la molécula, es decir,
indica la relación proporcional
ente el número de átomos de cada elemento presente en una molé-
cula,
sin que esta relación señale exactamente la cantidad de átomos. La
fórmula empírica se puede
determinar a partir del porcentaje de composición:
es decir, el análisis del compuesto en función de
sus elementos componentes.
Ejemplo: CH2O es la fórmula empírica que expresa la relación 1 C, 2 H y 1 O.
Esto nos indica que el
compuesto tiene un átomo de carbono, dos átomos
de hidrógeno y un átomo de oxígeno; la proporción
es 1:2:1.
Esta fórmula puede corresponder a varias sustancias, por eso se la escribe con
la notación (CH2)n.
Por ejemplo:
Si n = 1, CH2O, la fórmula corresponde al metanol.
Si n = 6, C6H12O6, la fórmula corresponde a la glucosa.
Para calcular la fórmula empírica se sigue los siguientes pasos:
1. Se divide la composición porcentual de cada elemento por su peso ató-
mico, lo cual nos da la proporción de cada elemento en la fórmula.
2. Si este cociente en algunos casos es decimal, como los átomos están en
proporciones de números enteros sencillos, se busca cociente de cocientes,
dividiendo cada uno de los obtenidos anteriormente por el menor de ellos.
3. Si con el paso anterior todavía los números no son enteros, se amplifican todos.
Una vez que los números den enteros, se los usa como subíndices al escribir
la formula empírica.
Formula molecular
La fórmula molecular es la fórmula real de compuesto. Además de la información
que suministra la
fórmula empírica, la fórmula molecular indica el número
real de átomos de cada elemento, presentes
en ese compuesto.
Para calcularla es necesario conocer la fórmula empírica y además la masa
molecular de la sustancia.
La fórmula molecular es un múltiplo de la fórmula empírica:
Fórmula molecular = (fórmula empírica)n
Para determinar el valor de n se divide la masa molecular de la sustancia por
la masa de la
fórmula empírica:
n= masa molecular /masa fórmula empírica
El resultado debe ser un número entero sencillo por el que luego se multiplica
cada uno de los
subíndices de los elementos en la fórmula empírica y así
se halla la cantidad exacta de cada elemento
de ese compuesto.
A
partir de la composición porcentual de un compuesto, podemos calcular la
fórmula empírica y la
molecular de dicho compuesto.
Ejemplo: El propileno es un hidrocarburo cuya masa molar es de 42.00 g y contiene 14.3% de H y
85.7% de C.
molecular de dicho compuesto.
Ejemplo: El propileno es un hidrocarburo cuya masa molar es de 42.00 g y contiene 14.3% de H y
85.7% de C.
¿Cuál es su fórmula
empírica?¿Cuál es su fórmula molecular?
PASO 1
Tomar como base 100 g del compuesto, lo cual nos permite expresar los
porcentajes como
gramos.
PASO 2
Convertir los gramos a moles.
PASO 3
Dividir cada valor obtenido en el paso 2 entre el menor de ellos. Si los
números obtenidos son
enteros, usarlos como subíndices para escribir la fórmula
empírica. Si los valores no son enteros , se
deben multiplicar por el entero
más pequeño que de por resultado otro entero.
PASO 4
Obtener la masa molar de la fórmula empírica y dividir, la masa real
proporcionada como dato del
problema entre la masa molar de la fórmula
empírica. El resultado debe ser entero o muy cercano a
un entero. Este número
conocido "n" (unidades de fórmula empírica) se multiplica por los
subíndices
de la fórmula empírica para obtener la fórmula molecular.
FÓRMULA EMPÍRICA: CH2
FÓRMULA MOLECULAR:
C3H6
Reacciones químicas
Una reacción química es un proceso en el cual una o más sustancias, denominadas reactivos, se
transforman en otra u otras sustancias con propiedades diferentes llamadas productos.
Una reacción química es un proceso en el cual una o más sustancias, denominadas reactivos, se
transforman en otra u otras sustancias con propiedades diferentes llamadas productos.
Las reacciones químicas se representan mediante
ecuaciones químicas, en las cuales
se emplean
diversidad de símbolos para indicar los procesos y las sustancias involucradas.
En una reacción química se pueden especificar dos componentes: Los reactivos o reactantes, que
diversidad de símbolos para indicar los procesos y las sustancias involucradas.
En una reacción química se pueden especificar dos componentes: Los reactivos o reactantes, que
forman el primer
miembro de la reacción; y los productos, que constituyen el segundo miembro de
la
reacción y son sustancias que se obtienen o se forman.
En algunas reacciones químicas se
indica el estado de los componentes de la reacción: sólido, líquido
y
gaseoso. También se puede indicar la
reacción con dos flechas, cuando se trata de una doble
reacción.
Toda ecuación química consta de dos miembros
separados por una flecha, que indica el
sentido de la
reacción. Las fórmulas correspondientes a los reactivos se escriben a la izquierda de la flecha,
mientras que las fórmulas de los productos se escriben a la derecha. La flecha se interpreta como «se
convierte(n) en…»
reacción. Las fórmulas correspondientes a los reactivos se escriben a la izquierda de la flecha,
mientras que las fórmulas de los productos se escriben a la derecha. La flecha se interpreta como «se
convierte(n) en…»
Si hay más de un reactivo o se forma más de un producto, las fórmulas de cada miembro de la
ecuación irán separadas por signos de adición.
encuentran tanto los reactivos como los productos. Así, si se trata de un gas se usa (g), un líquido (l),
un sólido (s), una solución (sol) y una disolución acuosa (ac).
número de moles de ese elemento o compuesto que intervienen en la reacción. En la reacción anterior,
1 mol de zinc, sólido, reacciona con 2 moles de ácido clorhídrico, en solución acuosa, para producir 1
mol de cloruro de zinc, en solución, y 1 mol de hidrógeno, gaseoso.
Tipos de reacciones químicas

Las reacciones químicas se pueden clasificar desde varios puntos de vista.
• Si existen cambios en el estado de oxidación de las sustancias se clasifican en redox y no redox.
• Teniendo en cuenta los procesos químicos ocurridos, se clasifican en reacciones de síntesis, de descomposición, de sustitución o de desplazamiento, además de doble descomposición, óxido reducción y neutralización.
•Teniendo en cuenta el sentido en el que se lleva a cabo una reacción, se clasifican en reacciones reversibles o irreversibles.
• Teniendo en cuenta los cambios energéticos producidos, se clasifican en exotérmicas o endotérmicas.
• Según el estado físico de las sustancias que intervienen, se clasifican en homogéneas y heterogéneas.
• Si existen cambios en el estado de oxidación de las sustancias se clasifican en redox y no redox.
• Teniendo en cuenta los procesos químicos ocurridos, se clasifican en reacciones de síntesis, de descomposición, de sustitución o de desplazamiento, además de doble descomposición, óxido reducción y neutralización.
•Teniendo en cuenta el sentido en el que se lleva a cabo una reacción, se clasifican en reacciones reversibles o irreversibles.
• Teniendo en cuenta los cambios energéticos producidos, se clasifican en exotérmicas o endotérmicas.
• Según el estado físico de las sustancias que intervienen, se clasifican en homogéneas y heterogéneas.
Reacciones de composición o de síntesis
Son las reacciones en las que dos o más sustancias se combinan para formar una sustancia nueva,
como se observa en los siguientes ejemplos:
Reacciones de descomposición o de disociación térmica
En estas reacciones los reactivos se dividen en sustancias más sencillas, con lo cual el número de
moléculas presentes en los productos es mayor que el número de moléculas en los reactivos. Así
ocurre en la descomposición térmica del clorato de potasio, según la siguiente reacción.
Se observa cómo el zinc desplaza al hidrógeno del ácido clorhídrico, produciéndose cloruro de zinc e
hidrógeno gaseoso.
Reacciones de doble descomposición
Se presentan cuando las sustancias reaccionantes se disocian en solución acuosa, dando lugar a pares
de iones, los cuales, a su vez, reaccionan entre sí para formar sustancias nuevas, más estables. Por
ejemplo, considérese la siguiente reacción:
Son las reacciones en las que dos o más sustancias se combinan para formar una sustancia nueva,
como se observa en los siguientes ejemplos:
2H2(g) + O2(g) ----> 2H2O(l)
HCl(g) + NH3(g) ----> NH4Cl(s)
C(s) + O2(g) ----> CO2(g)
En estas reacciones los reactivos se dividen en sustancias más sencillas, con lo cual el número de
moléculas presentes en los productos es mayor que el número de moléculas en los reactivos. Así
ocurre en la descomposición térmica del clorato de potasio, según la siguiente reacción.
2KClO3(s) + calor -----> 2KCl(s) + 3O2(g)
Reacciones de sustitución o de desplazamiento
Son aquellas en las que una sustancia simple reacciona con una más completa,
desplazando o
sustituyendo a uno de sus componentes. En la siguiente reacción:
2HCl(g) + Zn(s)-----> ZnCl2(ac) + H2(g)
Se observa cómo el zinc desplaza al hidrógeno del ácido clorhídrico, produciéndose cloruro de zinc e
hidrógeno gaseoso.
Reacciones de doble descomposición
Se presentan cuando las sustancias reaccionantes se disocian en solución acuosa, dando lugar a pares
de iones, los cuales, a su vez, reaccionan entre sí para formar sustancias nuevas, más estables. Por
ejemplo, considérese la siguiente reacción:
2NaCl(ac) + CaSO4(ac) -----> CaCl2(ac) + Na2SO4(ac)
En este proceso ocurren simultáneamente dos reacciones:
Luego se realiza el intercambio de especies, resultando las especies señaladas
en la primera ecuación.
Reacciones de oxidación-reducción (redox)
Las reacciones de oxidación-reducción se pueden considerar como la suma
de dos procesos
independientes de oxidación y reducción. La oxidación
es el proceso por el cual un elemento pierde
electrones, y como resultado
su número de oxidación aumenta. Por el contrario, la reacción de
reducción
es el proceso mediante el cual un elemento gana electrones, con lo cual
el número de
oxidación disminuye.
La oxidación y la reducción son procesos
simultáneos, que se denominan conjuntamente con la
abreviatura de procesos
redox.
Para ilustrar estos conceptos, se puede analizar el siguiente ejemplo. Si se introduce
una lámina de
zinc en una disolución concentrada de sulfato de cobre (II),
se observa que, pasados unos minutos, la
lámina se recubre de una capa delgada
de cobre.
La ecuación química que describe lo ocurrido es:
Zn(s) + CuSO4(sol) ----> Cu(s) + ZnSO4(sol).
Tanto el sulfato de cobre (II) como el sulfato de zinc son compuestos iónicos
que, al estar en solución
acuosa, se disocian formando iones:
Teniendo en cuenta este hecho, podemos escribir la anterior ecuación partiendo
de los iones, como
sigue:
Como el ion sulfato aparece en ambos miembros de la ecuación, esta se
puede escribir de manera más
sencilla así:
Esta ecuación nos indica que durante la reacción, el átomo de zinc, eléctricamente
neutro, se ha
transformado en un ion Zn2+, para lo cual ha tenido que
ceder dos electrones. En otras palabras, ha
experimentado un proceso
de oxidación. Por el contrario, el ion Cu2+ se ha transformado en un átomo
de
cobre eléctricamente neutro, para lo cual ha tenido que ganar dos electrones,
es decir, ha
experimentado un proceso de reducción.
Reacciones de neutralización
Son reacciones entre ácidos y bases, en las que se produce una sal y agua.
El ejemplo típico de este tipo de reacciones es la interacción entre
el ácido clorhídrico (HCl) y el
hidróxido de sodio (NaOH) para producir cloruro
de sodio y agua, como se muestra en la siguiente
reacción.
HCl(ac) + NaOH(ac) ----> NaCl(ac) + H2O
Reacciones reversibles
Son aquellas reacciones que se realizan simultáneamente en los dos sentidos.
Es decir, a medida que
se forman los productos, estos reaccionan entre sí para
formar nuevamente los reactivos. Con ello, se
crea una situación
de equilibrio químico en la cual la velocidad de reacción directa es igual a
la
velocidad de reacción inversa. Este tipo de reacciones se representa con
dos flechas, que separan los
reactivos de los productos.
Reacciones irreversibles
En este caso, los reactivos reaccionan completamente para convertirse en los
productos, sin la
posibilidad de que estos originen nuevamente los reactivos. La reacción se termina cuando se agota al
menos uno de los
reactivos.
En estas reacciones, los reactivos se encuentran separados de los productos
por una flecha que nos
indica que el sentido en que se desplaza la reacción
es único.
Reacciones exotérmicas
Estas reacciones reciben este nombre debido a que la energía que producen
casi siempre se presenta
como calor. La combustión, la fermentación, así como
un gran número de reacciones de formación de
compuestos a partir de sus
elementos son ejemplos de reacciones exotérmicas.
Frecuentemente, las reacciones exotérmicas necesitan un pequeño aporte
inicial de energía para
producirse, que puede ser suministrado por una pequeña
llama o una chispa eléctrica. Una vez iniciada
la reacción, la cantidad de energía
que se desprende es muy superior a la que se suministró al
comienzo de
la reacción.
Reacciones endotérmicas
Se denominan así porque en ellas es necesario suministrar energía al sistema de
reacción para hacer
que ocurran las transformaciones químicas. Esta energía
se suministra, en la mayoría de los casos, en
forma de calor. Reacciones como:
3C(s) + 2Fe2O3(s) + 467,47 kJ/mol ----> 4Fe(s) + 3CO2(g)
2HgO(s) + calor ----> 2Hg(l) + O2(g)
2KClO3(s) + calor ----> 2KCl(s) + 3O2(g)
en las que ocurre descomposición de compuestos, son ejemplos de reacciones
endotérmicas.
Una reacción química es la
manifestación de un cambio en la materia y la representación de un
fenómeno
químico. A su expresión escrita se le da el nombre de ecuación
química, en la cual se
expresa los
reactivos a la izquierda y los productos de la reacción a la derecha, ambos
separados por
una flecha.
Más exactamente, a la izquierda del
símbolo indicamos el contenido inicial del sistema en reacción
(reactivos), y a
la derecha el contenido del sistema final (productos). Cada sustancia se
representa por
su fórmula química, y posteriormente debemos ajustar toda
la ecuación.
El químico francés Lavoisier, empleando sistemáticamente la balanza en el análisis de numerosas
reacciones químicas, comprobó que la cantidad de materia que interviene en una reacción permanece
constante antes, durante y después de producida la transformación.
Esto quiere decir que, en un sistema en reacción, la suma de las masas de las sustancias que
intervienen como reactantes es idéntica a la suma de las masas de las sustancias que aparecen como
productos. Este enunciado se conoce como la ley de la conservación de la masa.
El químico francés Lavoisier, empleando sistemáticamente la balanza en el análisis de numerosas
reacciones químicas, comprobó que la cantidad de materia que interviene en una reacción permanece
constante antes, durante y después de producida la transformación.
Esto quiere decir que, en un sistema en reacción, la suma de las masas de las sustancias que
intervienen como reactantes es idéntica a la suma de las masas de las sustancias que aparecen como
productos. Este enunciado se conoce como la ley de la conservación de la masa.
Para balancear o equilibrar una ecuación, es necesario colocar coeficientes numéricos que antecedan a
las fórmulas correspondientes a los reactivos y productos involucrados, de tal manera que, al hacer el
conteo de los átomos, este número sea igual a ambos lados de la ecuación.
Para equilibrar o balancear
ecuaciones químicas, existen diversos métodos. En todos, el objetivo que
se
persigue es que la ecuación química cumpla con la ley de la conservación de la
materia.
Métodos para balancear ecuaciones
Métodos para balancear ecuaciones
Método de tanteo
El método de tanteo, se utiliza
principalmente para buscar el equilibrio de una reacción química de
una manera
rápida, en ecuaciones sencillas y completas, de tal forma que dicho
procedimiento no
retrase el proceso principal por el cual se requiera dicho
balanceo
Pasos a seguir:
- Tomemos
en cuenta que una reacción química al estar en equilibrio, debe mantener la
misma
cantidad de moléculas o átomos, tanto del lado de los reactivos como del
lado de los productos.
- Si
existe mayor cantidad de átomos de x
elemento de un lado, se equilibra completando el número
de átomos que
tenga en el otro lado de la reacción.
- Es
recomendable comenzar en el siguiente orden: metales, no metales, hidrógeno y por último
oxígeno.
Método algebraico
Este
método es un proceso matemático que consistente en asignar literales a cada una
de las especies,
crear ecuaciones en función de los átomos y al resolver las
ecuaciones, determinar el valor de los
coeficientes. Ecuación a balancear:
FeS
+ O2
®
Fe2O3
+ SO2
Los
pasos a seguir son los siguientes:
1.Escribir
una letra, empezando por A, sobre las especies de la ecuación:
A
|
B
|
C
|
D
|
|||
FeS
|
+
|
O2
|
à
|
Fe2O3
|
+
|
SO2
|
2.
Escribir los elementos y para cada uno de ellos establecer cuántos hay en
reactivos y en productos,
con respecto a la variable. Por ejemplo hay un Fe en
reactivos y dos en productos, pero en función de
las literales donde se
localizan las especies (A y C) se establece la ecuación A
= 2C
.
El
símbolo produce (®
) equivale al signo igual a (=).
Fe A = 2C
S A = D
O 2B = 3C + 2D
A
|
B
|
C
|
D
|
|||
FeS
|
+
|
O2
|
à
|
Fe2O3
|
+
|
SO2
|
3.
Utilizando esas ecuaciones, dar un valor a cualquier letra que nos permita
resolver una ecuación
(obtener el valor de una literal o variable) y obtener
después el valor de las demás variables. Es decir
se asigna un valor al azar
(generalmente se le asigna el 2) a alguna variable en una ecuación, en este
caso C = 2 , de tal forma que al sustituir el valor en la primera ecuación se
encontrará el valor de A.
Sustituyendo el valor de A en la segunda ecuación se
encuentra el valor de D y finalmente en la
tercera ecuación se sustituyen los
valores de C y D para encontrar el valor de B.
Fe A = 2C Sí C =2 A= D 2B = 3C + 2D
S A = D A= 2C D = 4 2B = (3)(2) + (2)(4)
O 2B = 3C + 2D A= 2(2) 2B = 14
S A = D A= 2C D = 4 2B = (3)(2) + (2)(4)
O 2B = 3C + 2D A= 2(2) 2B = 14
A = 4 B = 14/2 B = 7
4. Asignar a cada una de las especies el valor encontrado para cada una de las variables:
A
|
B
|
C
|
D
|
|||
4 FeS
|
+
|
7 O2
|
à
|
2Fe2O3
|
+
|
4SO2
|
Método Redox
En las reacciones de óxido-reducción hay pérdida o ganancia de electrones. En consecuencia, los
conceptos de oxidación y de reducción pueden expresarse en función del cambio del número de
oxidación.
Se considera que un elemento se oxida cuando aumenta su estado de oxidación, o sea, hay una pérdida
de electrones, mientras que en la reducción hay una disminución en el estado de oxidación; luego, hay
ganancia de electrones.
Desde el punto de vista de la transferencia de electrones, un agente oxidante es aquel que es capaz de
captar electrones, provocando la oxidación de una sustancia, mientras que un agente reductor es aquel
que es capaz de ceder electrones, provocando que otras especies se reduzcan.
En las reacciones de óxido-reducción hay pérdida o ganancia de electrones. En consecuencia, los
conceptos de oxidación y de reducción pueden expresarse en función del cambio del número de
oxidación.
Se considera que un elemento se oxida cuando aumenta su estado de oxidación, o sea, hay una pérdida
de electrones, mientras que en la reducción hay una disminución en el estado de oxidación; luego, hay
ganancia de electrones.
Desde el punto de vista de la transferencia de electrones, un agente oxidante es aquel que es capaz de
captar electrones, provocando la oxidación de una sustancia, mientras que un agente reductor es aquel
que es capaz de ceder electrones, provocando que otras especies se reduzcan.
La oxidación se refiere a:
*La ganancia de oxígeno por parte de una
molécula
*La pérdida de hidrógeno en una molécula
*La pérdida de electrones que sufre un
átomo o grupo de átomos
*Aumentando en consecuencia su número de oxidación
La reducción se refiere a:
*La pérdida de oxígeno por parte de una
molécula
*La ganancia de hidrógeno en una molécula
*La ganancia de electrones que sufre un
átomo o grupo de átomos
*Disminución o reducción en su número de oxidación
*Los procesos de oxidación y reducción
suceden simultáneamente y nunca de manera aislada, por lo que se denominan reacciones
redox.
Pasos para realizar el metodo redox
Paso 1. Asignar el número de oxidación de todos
los elementos presentes en la reacción y reconocer
los elementos que se oxidan
y reducen.
Nota: Todo elemento libre tiene número de
oxidación cero.
Paso 2.
Escribir las semirreacciones de
oxidación y reducción con los electrones de intercambio.
Paso 3. Balancear
el número de átomos en ambos lados de las semirreacciones. En
este caso están balanceados.
Paso 4.
Igualar el número de electrones ganados y cedidos:
Nota: El número de electrones ganados
debe ser igual al número de electrones cedidos.
Paso 5. Colocar
los coeficientes encontrados en la ecuación original donde se verificó el
cambio del número de oxidación.
Paso 6. Completar
el balanceo ajustando el número de átomos en ambos lados de la reacción
por tanteo
Observaciones
*Observación 1: Cuando
los coeficientes calculados, no igualan la ecuación es recomendable
duplicarlos.
*Observación 2: Cuando hay dos o más oxidaciones
o reducciones, se pueden sumar las oxidaciones y reducciones para igualar la
ecuación.
*Observación 3: Cuando en una misma molécula, un
átomo se oxida y otro se reduce para obtener el coeficiente de oxidación y
reducción se hace una resta
*Observación 4: En los peróxidos la valencia del
oxígeno es - 1
Estequiometría
Para resolver problemas que impliquen cálculos estequiométricos se precisan
cuatro etapas: primero,
se escribe la ecuación química balanceada; luego, se convierte a moles la información suministrada en
el problema; a continuación, se analizan las relaciones molares en la ecuación química y, finalmente,
se pasa de moles a la unidad deseada.
se escribe la ecuación química balanceada; luego, se convierte a moles la información suministrada en
el problema; a continuación, se analizan las relaciones molares en la ecuación química y, finalmente,
se pasa de moles a la unidad deseada.
La estequiometria es el área de la química que
estudia la relación entre las moléculas de reactantes y
productos dentro de una
reacción química.
Como sabemos, para que se forme un
compuesto debe haber una separación, combinación o
reordenamiento de los
elementos, lo que se puede ilustrar por medio de una reacción, la cual
representa el proceso que ocurrió para que un determinado reactante llegara a
ser un producto.
Reactantes
→Productos
Ley de proporciones definidas
Cuando se hace reaccionar dos elementos químicos para formar un determinado
compuesto, dichos
elementos siempre reaccionan en la misma proporción (2 g de hidrógeno por cada 16 g de oxígeno
forman un mol de agua). De esta manera, si uno de estos elementos se encuentra en exceso con
relación al otro, esta cantidad sobrante no tomará parte en la transformación.
Esta proporción se mantiene a pesar de que se prepare el compuesto por diferentes procedimientos.
Así, podemos preparar agua combinando directamente hidrógeno y oxígeno, o bien podemos obtenerla
como uno de los productos de la combustión de la madera. Tanto en un caso como en el otro, la
proporción en la que se combinan el hidrógeno y el oxígeno siempre es la misma.
Los hechos anteriores se resumen en la llamada ley de las proporciones definidas o ley de las
proporciones constantes, enunciada en 1799 por el químico francés Joseph Louis Proust.
Las proporciones en las que se encuentran los distintos elementos que forman un compuesto son
constantes e independientes del proceso seguido para su formación
elementos siempre reaccionan en la misma proporción (2 g de hidrógeno por cada 16 g de oxígeno
forman un mol de agua). De esta manera, si uno de estos elementos se encuentra en exceso con
relación al otro, esta cantidad sobrante no tomará parte en la transformación.
Esta proporción se mantiene a pesar de que se prepare el compuesto por diferentes procedimientos.
Así, podemos preparar agua combinando directamente hidrógeno y oxígeno, o bien podemos obtenerla
como uno de los productos de la combustión de la madera. Tanto en un caso como en el otro, la
proporción en la que se combinan el hidrógeno y el oxígeno siempre es la misma.
Los hechos anteriores se resumen en la llamada ley de las proporciones definidas o ley de las
proporciones constantes, enunciada en 1799 por el químico francés Joseph Louis Proust.
Las proporciones en las que se encuentran los distintos elementos que forman un compuesto son
constantes e independientes del proceso seguido para su formación
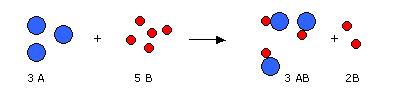
Ley de proporciones múltiples
Dalton se sorprendió al comprobar que la reacción entre las masas de cobre que reaccionaban con 1 g
de oxígeno para formar dos compuestos distintos resultó ser 2:1, una relación entre números enteros.
Para descartar que este fenómeno haya sido una casualidad, demostró en el laboratorio que en otros
casos (óxidos y sales) ocurría lo mismo: siempre se obtenían relaciones de números enteros sencillos.
Con esta información, dedujo la ley de las proporciones múltiples, enunciada así:
Las cantidades de un mismo elemento, que se combinan con una cantidad fija de otro para formar
varios compuestos, están en una relación de números enteros sencillos.
Dalton se sorprendió al comprobar que la reacción entre las masas de cobre que reaccionaban con 1 g
de oxígeno para formar dos compuestos distintos resultó ser 2:1, una relación entre números enteros.
Para descartar que este fenómeno haya sido una casualidad, demostró en el laboratorio que en otros
casos (óxidos y sales) ocurría lo mismo: siempre se obtenían relaciones de números enteros sencillos.
Con esta información, dedujo la ley de las proporciones múltiples, enunciada así:
Las cantidades de un mismo elemento, que se combinan con una cantidad fija de otro para formar
varios compuestos, están en una relación de números enteros sencillos.
Un ejemplo
de aplicación de la ley de Dalton es el siguiente: 16 g de oxígeno pueden
combinarse con
14 g de nitrógeno para producir monóxido de nitrógeno, o con 7 g
de nitrógeno para formar dióxido
de nitrógeno. Se obtiene una relación de
números enteros sencilla entre las cantidades variables de
nitrógeno que se
combinan con una misma cantidad de oxígeno. 7:14 = 1:2
Reactivo limitante y reactivo en exceso
Al reactivo que se consume totalmente en una reacción química se le llama reactivo limitante o
reactivo límite; de él depende la cantidad máxima de producto que se forma. Cuando la reacción cesa,
es porque el reactivo límite se ha consumido por completo. El reactivo que sobra se llama reactivo en
exceso o reactivo excedente.
Para explicar estos conceptos, se puede analizar el siguiente ejemplo. Se dispone de cuatro rebanadas
de jamón y seis trozos de pan, y se desea hacer tantos emparedados como sea posible, utilizando dos
trozos de pan y una rebanada de jamón para cada uno. Un cálculo rápido deja ver que solo se pueden
hacer tres emparedados, pues solamente se tienen seis trozos de pan y no alcanza para utilizar todo el
jamón disponible. El pan representa el reactivo límite y la rebanada de jamón sobrante representa el
reactivo en exceso. Por lo tanto, la cantidad de producto (emparedados) se calcula con base en el
reactivo límite: para el ejemplo, el pan. Es obvio que es el reactivo límite el que determina la cantidad
de producto posible en cada reacción.
Al reactivo que se consume totalmente en una reacción química se le llama reactivo limitante o
reactivo límite; de él depende la cantidad máxima de producto que se forma. Cuando la reacción cesa,
es porque el reactivo límite se ha consumido por completo. El reactivo que sobra se llama reactivo en
exceso o reactivo excedente.
Para explicar estos conceptos, se puede analizar el siguiente ejemplo. Se dispone de cuatro rebanadas
de jamón y seis trozos de pan, y se desea hacer tantos emparedados como sea posible, utilizando dos
trozos de pan y una rebanada de jamón para cada uno. Un cálculo rápido deja ver que solo se pueden
hacer tres emparedados, pues solamente se tienen seis trozos de pan y no alcanza para utilizar todo el
jamón disponible. El pan representa el reactivo límite y la rebanada de jamón sobrante representa el
reactivo en exceso. Por lo tanto, la cantidad de producto (emparedados) se calcula con base en el
reactivo límite: para el ejemplo, el pan. Es obvio que es el reactivo límite el que determina la cantidad
de producto posible en cada reacción.
El reactivo
limitante es aquel que limita la reacción. Es decir:
Una vez que este reactivo se acaba, termina la reacción. El reactivo que sobra se llama reactivo
excedente. Por lo tanto, la cantidad de producto que se forme depende de la cantidad de reactivo
limitante. Este depende de la reacción y es distinto para cada una de ellas.
Una vez que este reactivo se acaba, termina la reacción. El reactivo que sobra se llama reactivo
excedente. Por lo tanto, la cantidad de producto que se forme depende de la cantidad de reactivo
limitante. Este depende de la reacción y es distinto para cada una de ellas.
Por ejemplo:
Si debemos hacer sándwich de queso, y para ello disponemos de siete panes y sólo cinco láminas de
queso, ¿cuántos sándwiches podré hacer? Sólo podré hacer cinco sándwiches, y por tanto las láminas
de queso serán el reactivo limitante de este proceso, mientras que el pan será el reactivo excedente.
Si debemos hacer sándwich de queso, y para ello disponemos de siete panes y sólo cinco láminas de
queso, ¿cuántos sándwiches podré hacer? Sólo podré hacer cinco sándwiches, y por tanto las láminas
de queso serán el reactivo limitante de este proceso, mientras que el pan será el reactivo excedente.
Reactivo limitante (R.L):
Aquel reactivo que se consume en su
totalidad durante la reacción y que limita la cantidad de
producto a obtener, siendo que existe otro que no se consume en su totalidad y
del cual sobra
un resto sin reaccionar.
Reactivo en exceso (R.E):
Aquel reactivo que no se consume en su
totalidad durante la reacción y del cual sobra un resto
sin
reaccionar, siendo que existe otro que limita la cantidad de producto a
obtener y que no se
consume en su totalidad.
Pasos:
1.Igualar la ecuación
2.Calcular UMA
3.Calcular moles
4.Dividir
los moles obtenidos para el coeficiente molar
El
compuesto con menor número de moles será el reactivo limitante y el mayor será
el reactivo en
exceso.
A
partir de los moles obtenidos del reactivo limitante, se busca mediante regla
de tres el valor de
moles del otro reactivo.
Para
calcular el exceso se trabaja con los moles del compuesto en exceso menos el
valor obtenido de
la regla de tres
Para calcular la masa del exceso se multiplica
los moles por la UMA
Ejemplo:
Si tengo
15 moles de hidrógeno y 10 moles de nitrógeno, ¿cuál será el reactivo
limitante, cuál el
reactivo en exceso, y cuántos moles de amoníaco se podrán obtener?
Lo primero
que debemos hacer es ajustar la reacción, es decir, colocar los coeficientes
estequiométricos adecuados, para que el número de átomos en los reactivos sea
igual al número de
átomos en los productos, y de esta manera cumplir con la ley
de conservación de la materia.
Entonces la reacción ajustada (al
tanteo), quedará de la siguiente manera:
3H2
+ N2 = 2NH3
Esto se interpreta así: 3 moléculas
o moles de hidrógeno reaccionan con una molécula o mol de
nitrógeno para
obtener 2 moles o moléculas de amoníaco.
Entonces, si tengo 15 moles
de hidrógeno, reaccionarán con 5 moles de nitrógeno, sobrando otros 5
moles de este elemento. Por lo tanto en este caso, el hidrógeno es el reactivo
limitante, y el nitrógeno,
el reactivo en exceso. Si con tres moles de
hidrógeno se producirían dos moles de amoníaco, con 15
moles de hidrógeno
obtendremos 10 moles de amoníaco.
Porcentaje de Rendimiento
La cantidad máxima de producto que puede obtenerse de acuerdo con la ecuación química, a partir de
cierta cantidad de reaccionantes, se denomina rendimiento teórico.
Por muchas razones, la cantidad de producto que se obtiene en el laboratorio o en la industria en una
reacción química, puede ser menor que la cantidad teóricamente posible (figura 24). Algunas de las
razones son las siguientes:
• La falta de cuidado al manipular el producto obtenido. • Las condiciones de la reacción no son adecuadas; por ejemplo, la temperatura o la presión del sistema de reacción no son las ideales para el proceso.
• La separación del producto deseado de la mezcla de reacción es muy difícil y no todo el producto logra aislarse.
• En algunos casos, un conjunto particular de reactivo da lugar a dos o más reacciones simultáneas, formando productos indeseables además de los deseados.
• La calidad o la pureza de las materias primas no es óptima.
La cantidad real de producto que se obtiene se denomina rendimiento real. El rendimiento real de una
reacción se expresa en términos de % mediante la siguiente expresión:
La cantidad máxima de producto que puede obtenerse de acuerdo con la ecuación química, a partir de
cierta cantidad de reaccionantes, se denomina rendimiento teórico.
Por muchas razones, la cantidad de producto que se obtiene en el laboratorio o en la industria en una
reacción química, puede ser menor que la cantidad teóricamente posible (figura 24). Algunas de las
razones son las siguientes:
• La falta de cuidado al manipular el producto obtenido. • Las condiciones de la reacción no son adecuadas; por ejemplo, la temperatura o la presión del sistema de reacción no son las ideales para el proceso.
• La separación del producto deseado de la mezcla de reacción es muy difícil y no todo el producto logra aislarse.
• En algunos casos, un conjunto particular de reactivo da lugar a dos o más reacciones simultáneas, formando productos indeseables además de los deseados.
• La calidad o la pureza de las materias primas no es óptima.
La cantidad real de producto que se obtiene se denomina rendimiento real. El rendimiento real de una
reacción se expresa en términos de % mediante la siguiente expresión:
Rendimiento experimental es el que se obtiene después de un proceso de reacción, que se puede ver
afectado por factores como la presión, temperatura, cantidades de reactivos, la pureza, etc.
Rendimiento teórico: se calcula a partir del reactivo limitante
Pasos para calcular el porcentaje de rendimiento
1.
Balancear la reacción
2.
Convertir a moles todas las cantidades
3.
Determinar el reactivo limitante
4.
Calcular el rendimiento teórico
5.
Identificar el rendimiento experimental
6.
Calcular el porcentaje de rendimiento
%Pureza
Por lo general, las sustancias que intervienen en los procesos químicos contienen
impurezas. Estas
impurezas representan un peso adicional que aumenta
el de la sustancia pura, lo que afecta la calidad
del producto. Por ello, es
importante cuantificar las impurezas antes de hacer el cálculo
estequiométrico,
para conocer la cantidad real de reactivo puro..
Con frecuencia en los
laboratorios e industrias reactivos que se emplean presentan impurezas y
esto
afecta la calidad del producto, el cual no se obtendrá en estado puro.
Como las relaciones estequiométricas se basan en sustancias puras es
necesario estar seguros de que
las cantidades tomadas para los cálculos
correspondan a material puro que se encuentra en los
reactivos con impurezas.
La cantidad sustancia
pura (SP)
de una sustancia
impura (SI)
se puede calcular de la siguiente
manera:
SP = (SI x %Pureza)/100












No hay comentarios:
Publicar un comentario