Unidad VI
Gas ideal
Es
aquel que cumple exactamente con las leyes establecidas para los gases, es
decir, un gas donde no hay fuerzas de atracción o repulsión entre las moléculas
y el cual el volumen real de las moléculas es insignificante.
Propiedades de los gases
Para definir el estado de un gas se necesitan cuatro magnitudes: masa, presión, volumen y temperatura.
Masa.
Representa la cantidad de materia del gas y suele asociarse con el número de moles (n).
Presión.
Se define como la fuerza por unidad de área, F/A. La presión P, de un gas, es el resultado de la fuerza ejercida por las partículas del gas al chocar contra las paredes del recipiente. La presión determina la dirección de flujo del gas. Se puede expresar en atmósferas (atm), milímetros de mercurio (mmHg), pascales (Pa) o kilopascales (kPa).
La presión que ejerce el aire sobre la superficie de la tierra se llama presión atmosférica y varía de acuerdo con la altura sobre el nivel del mar; se mide con un instrumento llamado barómetro (figura 16). Las medidas hechas a nivel del mar y a 0 °C dan un promedio de 760 mm de Hg que son equivalentes a 1 atm, a 101,3 kPa, a 1,0332 kg/cm2 , a 7,6 ? 102 torr (Torricelli) o a 1,01325 bares, dependiendo de la unidad en la que se quiera expresar.
En el estudio de los gases es necesario tener claridad sobre dos conceptos: la presión ejercida por un gas y la presión ejercida sobre el gas.
La presión ejercida por el gas es la que ejercen las moléculas del propio gas. Se le llama presión interna porque actúa desde adentro hacia afuera a través de los choques de sus moléculas con el recipiente que las contiene. En cambio, la presión ejercida sobre un gas corresponde a la fuerza que se ejerce sobre él, comprimiendo sus moléculas, para que ocupen un volumen determinado. Esta se llama presión externa
Propiedades de los gases
Para definir el estado de un gas se necesitan cuatro magnitudes: masa, presión, volumen y temperatura.
Masa.
Representa la cantidad de materia del gas y suele asociarse con el número de moles (n).
Presión.
Se define como la fuerza por unidad de área, F/A. La presión P, de un gas, es el resultado de la fuerza ejercida por las partículas del gas al chocar contra las paredes del recipiente. La presión determina la dirección de flujo del gas. Se puede expresar en atmósferas (atm), milímetros de mercurio (mmHg), pascales (Pa) o kilopascales (kPa).
La presión que ejerce el aire sobre la superficie de la tierra se llama presión atmosférica y varía de acuerdo con la altura sobre el nivel del mar; se mide con un instrumento llamado barómetro (figura 16). Las medidas hechas a nivel del mar y a 0 °C dan un promedio de 760 mm de Hg que son equivalentes a 1 atm, a 101,3 kPa, a 1,0332 kg/cm2 , a 7,6 ? 102 torr (Torricelli) o a 1,01325 bares, dependiendo de la unidad en la que se quiera expresar.
En el estudio de los gases es necesario tener claridad sobre dos conceptos: la presión ejercida por un gas y la presión ejercida sobre el gas.
La presión ejercida por el gas es la que ejercen las moléculas del propio gas. Se le llama presión interna porque actúa desde adentro hacia afuera a través de los choques de sus moléculas con el recipiente que las contiene. En cambio, la presión ejercida sobre un gas corresponde a la fuerza que se ejerce sobre él, comprimiendo sus moléculas, para que ocupen un volumen determinado. Esta se llama presión externa
Volumen.
Es el espacio en el cual se mueven las moléculas. Está dado por el volumen del recipiente que lo contiene, pues por lo general se desprecia el espacio ocupado por las moléculas. El volumen (V) de un gas se puede expresar en m3 , cm3 , litros o mililitros. La unidad más empleada en los cálculos que se realizan con gases es el litro.
Temperatura.
Es una propiedad que determina la dirección del flujo del calor. Se define como el grado de movimiento de las partículas de un sistema bien sea un sólido, un líquido o un gas. La temperatura en los gases se expresa en la escala Kelvin, llamada también escala absoluta.
Puesto que muchos gases se encuentran a muy bajas temperaturas (negativas en la escala centígrada), es conveniente al realizar cálculos matemáticos, transformar primero los grados centígrados en grados absolutos (fi gura 18). Cuando se tiene 1 mol de gas, a 1 atm de presión, a una temperatura de 273 K y ocupa un volumen de 22,4 L, se dice que se encuentra en condiciones normales (C.N.)
LEYES DE LOS GASES
Las principales leyes que rigen el estado
gaseoso son:
a)Ley
de Boyle – Mariotte
b)Ley
de Jacques Charles I y II
c)Ley
de Gay Lussac
d)Ley
Combinada – Ecuación general
e)Ley
de Dalton
En las leyes de los gases
intervienen 3 factores importantes que son: la presión, el volumen y la
temperatura, por lo tanto se usarán las siguientes medidas.
Presión (P):
•1 atm = 760 torr o 760
mm Hg
•1 atm = 14,7
libras/pulgada2 o 14,7 psi
•1 atm = 1,033 gr/cm2
•1 atm = 1,013 x 106 dinas/cm2
Temperatura (T):
•°C grados centígrados
•K grados Kelvin (temperatura absoluta)
•°F grados Fahrenheit
Volumen (V):
•Litro = 1000 ml o 1000 cc (cm3)
•1 m3 = 1.000 litros
•1 galón = 3,78 litros
•1 pie3 = 28,32 litros
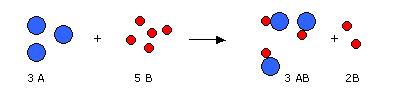
Ley de Boylet-Mariotte
En 1660 el químico inglés Robert Boyle (1627–1691) realizó una serie de experiencias que relacionaban el volumen y la presión de un gas, a temperatura constante. Boyle observó que cuando la presión sobre el gas aumentaba, el volumen se reducía, y a la inversa, cuando la presión disminuía, el volumen aumentaba. Con base en los resultados de sus experimentos Boyle formuló la siguiente ley:
En 1660 el químico inglés Robert Boyle (1627–1691) realizó una serie de experiencias que relacionaban el volumen y la presión de un gas, a temperatura constante. Boyle observó que cuando la presión sobre el gas aumentaba, el volumen se reducía, y a la inversa, cuando la presión disminuía, el volumen aumentaba. Con base en los resultados de sus experimentos Boyle formuló la siguiente ley:
“Cuando
la temperatura permanece constante los volúmenes de los gases son inversamente
proporcionales a las presiones”, es decir si la presión aumenta, el volumen
disminuye.
La ley de Boyle puede expresarse matemáticamente como:
La ley de Boyle puede expresarse matemáticamente como:
V α 1/P cuando T = Constante
Al introducir una constante de proporcionalidad la ley se expresa como:
P.V=k, donde P representa la presión, V el volumen y k es una constante de proporcionalidad. Es
decir, si una determinada masa de gas ocupa un volumen V1
, cuando la presión
es P1
y un volumen V2
, cuando la presión es P2
, el producto de la presión por
el volumen tienen el mismo valor en ambas situaciones:
Con esta expresión podemos determinar el factor volumen y el factor de
presión considerando el efecto que tiene el cambio de volumen o de presión
sobre la presión o el volumen iniciales (V1
o P1
) y la forma en que afectará este
cambio a la presión o volumen finales (V2
o P2
).

Ley de Charles I
La temperatura también afecta el volumen de los gases. Los experimentos que realizó en un principio el físico francés Jacques Charles en 1787 y que fueron confrontados por Joseph Gay-Lussac en 1802, demostraron que el volumen de un gas se incrementa en 1/273 veces su valor a 0 °C por grado de temperatura que aumente.
La ley de Charles establece que: a presión constante, el volumen de la masa fija de un gas dado es directamente proporcional a la temperatura Kelvin. Esto significa que si la temperatura Kelvin se duplica a presión constante, el volumen se duplica; si la temperatura se reduce a la mitad, el volumen se reduce a la mitad. Matemáticamente se expresa como:
La ecuación muestra que el volumen de una cierta masa de gas es directamente proporcional a la temperatura, sólo si la presión es constante.
La temperatura también afecta el volumen de los gases. Los experimentos que realizó en un principio el físico francés Jacques Charles en 1787 y que fueron confrontados por Joseph Gay-Lussac en 1802, demostraron que el volumen de un gas se incrementa en 1/273 veces su valor a 0 °C por grado de temperatura que aumente.
La ley de Charles establece que: a presión constante, el volumen de la masa fija de un gas dado es directamente proporcional a la temperatura Kelvin. Esto significa que si la temperatura Kelvin se duplica a presión constante, el volumen se duplica; si la temperatura se reduce a la mitad, el volumen se reduce a la mitad. Matemáticamente se expresa como:
donde V representa el volumen, T la temperatura y k la constante de proporcionalidad.
Es decir, si una determinada masa de gas ocupa un volumen
V1
, cuando la temperatura es T1
y si ocupa un volumen V2
a una temperatura
T2
, el cociente entre el volumen y la temperatura tiene el mismo valor
en ambas situaciones:
La ecuación muestra que el volumen de una cierta masa de gas es directamente proporcional a la temperatura, sólo si la presión es constante.

Ley de Charles II
Como
principio fundamental se tiene que una molécula de cualquier gas que se
encuentre a cero
grados centígrados y una atmósfera de presión ocupa el volumen
de 22,4 litros al cual se lo llama
“volumen molar”. Es necesario recordar que las masas
moleculares de las moles de los diferentes
gases son diferentes pero el volumen
es igual para todos ellos.
VT= volumen total o final
∝ =
coeficiente dilatación gases= 0,00366 = 1/273
V o = volumen molar
= 22,4 litros
T= temperatura
Ley de Gay Lussac
En 1808, el químico francés J. L. Gay-Lussac (1778-1850) logró establecer
claramente la relación entre la presión y el volumen de un gas: si el volumen
de un gas no cambia mientras lo calentamos, la presión del gas aumenta en
la misma proporción en que se incremente la temperatura. Esto
significa que la presión que ejerce un gas es directamente proporcional a la
temperatura, siempre que el volumen se mantenga constante:
donde P simboliza la presión, T la temperatura y k la constante de proporcionalidad.
En determinadas condiciones iniciales y finales de presión y
volumen, cuando el volumen del gas no cambia, el cociente P/T es siempre
el mismo, es decir:
.
Ley combinada
Las leyes de Boyle, Charles y de Gay Lussac se pueden combinar en una ley que
nos indica a la vez la dependencia del volumen de una cierta masa de
gas con respecto a la presión y la temperatura. Esta ley conocida, como
ley combinada de los gases se enuncia como sigue: para una masa determinada
de cualquier gas, se cumple que el producto de la presión por
el volumen dividido entre el valor de la temperatura es una constante:
El valor de esta constante depende de la masa y no del tipo de gas
utilizado, ya que todos los gases se comportan de la misma manera.
La ley combinada de los gases puede expresarse:
donde las temperaturas T1
y T2
se expresan en Kelvin (K).
Ecuación General
Combinando las leyes de los gases, se puede obtener una expresión que relacione las
cuatro variables:
Incorporando una constante de proporcionalidad, R (conocida también como
constante universal de los gases ideales), obtenemos:
La constante universal de los gases se calcula tomando en cuenta las condiciones normales de un gas, esto es: una mol, 1 atm, 22,4 litros y 273 K. Por lo tanto si en la fórmula general despejamos R, tendremos:
Finalmente, obtenemos la ecuación de estado para los gases ideales:
P.V=n.R.T
Donde:
P =
presión
V =
volumen
N =
número de moles = Pa =
(Peso en gramos del gas)
Ma
(Peso molecular del gas)
T =
Temperatura en grados Kelvin
R =
Constante universal de los gases = 0.082 at – li
mol . K
Ley de Dalton
John Dalton determinó que cuando se ponen en un mismo recipiente
dos o más gases diferentes que no reaccionan entre sí: la presión ejercida
por la mezcla de gases es igual a la suma de las presiones parciales
de todos ellos. En otras palabras, cada gas ejerce una presión
independiente de las otras como si fuera el único gas dentro del
recipiente.
“La presión total de una mezcla de dos o más gases que no reaccionan entre sí es igual a la suma de las presiones de los componentes”
En general, la ley de Dalton se puede expresar así:
Los subíndices (1, 2, 3) indican los distintos gases que ocupan el
mismo recipiente.
La presión ejercida por un gas es proporcional al número de moléculas
presentes del gas e independiente de la naturaleza.
Para hallar la presión parcial de cada gas en una mezcla se multiplica
la presión total por la fracción molar respectiva así:
La fracción molar se define como el número de moles del componente
(1) dividido entre el número de moles totales:
Solución
Se
denomina así a la mezcla de dos o más componentes en cantidades fijas o no, que
forman un todo homogéneo, esto es, que no existan zonas de separación o fases.
Una solución es una mezcla físicamente homogénea, formada por dos
o más sustancias que reciben el nombre de solvente y soluto.
- El solvente es la sustancia que por lo general se encuentra en mayor
proporción dentro de la disolución. Las soluciones más importantes
son las acuosas, por lo tanto, el solvente más común es el agua.
El agua es una de las sustancias más abundante en la biosfera. Su capacidad para formar soluciones con un sinnúmero de sustancias, hace que, cerca del 90% de las disoluciones sean acuosas.
- El soluto es la sustancia que, por lo general, se encuentra en menor proporción dentro de la solución. Por ejemplo, en una solución acuosa de cloruro de sodio, el agua es el solvente y la sal es el soluto.
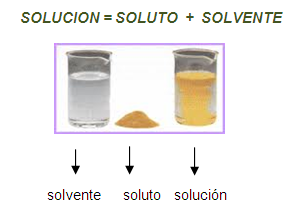
Cualquier sustancia, sin importar el estado de agregación de sus moléculas,
puede formar soluciones con otras. Según el estado físico en el
que se encuentren las sustancias involucradas se pueden clasificar en
sólidas, líquidas y gaseosas.
También puede ocurrir que los componentes
de la solución se presenten en diferentes estados. Así, cuando uno de los
componentes es un gas o un sólido y el otro es un líquido, el primero se
denomina soluto y el segundo solvente.
Las soluciones también se pueden clasificar según la cantidad de soluto
que contienen, como:
•Diluidas:
Son aquellas en las que hay muy poca cantidad de soluto disuelto, el solvente puede seguir
admitiendo más soluto. Un ejemplo es la cantidad de
minerales en el agua de mesa: tiene una cantidad
muy baja que nos permite
asimilarlos correctamente.
•Concentradas:
Son aquellas en las que hay bastante cantidad de soluto disuelto, pero el solvente todavía puede
seguir admitiendo más soluto. Un ejemplo podría ser el agua
de mar: contiene una gran cantidad de sal disuelta, pero todavía sería posible
disolver más cantidad de sal.
•Saturadas
Son aquellas en las que no se puede seguir admitiendo más
soluto, pues el solvente ya no lo puede
disolver. Si la temperatura aumenta, la capacidad para admitir más
soluto aumenta.
Lo podemos asociar con
el aforo de un cine: si una sala tiene capacidad para 100 personas, éste es el
máximo número de personas que podrán entrar. De igual forma, una solución
saturada es aquella en
la que se ha disuelto la máxima cantidad de gramos de soluto que el solvente puede acoger.
la que se ha disuelto la máxima cantidad de gramos de soluto que el solvente puede acoger.
•Sobresaturadas
Si la cantidad de soluto es mayor de la que puede disolver el solvente a una temperatura dada. Este
tipo de soluciones se consiguen cuando se logra disolver el soluto por encima de su punto de
saturación y son muy inestables, por lo que, frecuentemente, el soluto en exceso tiende a precipitarse
al fondo del recipiente.
Si la cantidad de soluto es mayor de la que puede disolver el solvente a una temperatura dada. Este
tipo de soluciones se consiguen cuando se logra disolver el soluto por encima de su punto de
saturación y son muy inestables, por lo que, frecuentemente, el soluto en exceso tiende a precipitarse
al fondo del recipiente.
La capacidad de disolver el soluto en exceso aumenta con la
temperatura: si calentamos la solución,
es posible disolver todo el soluto
es posible disolver todo el soluto
Concentraciones
De acuerdo con la cantidad de soluto presente, tendremos soluciones
diluidas, saturadas y sobresaturadas. Si bien podemos diferenciar una
solución concentrada de una diluida, no podemos determinar exactamente
que tan concentrada o diluida está. A continuación veremos cómo
se cuantifica la cantidad de soluto presente en una solución, a través del
concepto de concentración.
La concentración de una solución expresa la cantidad de soluto presente
en una cantidad dada de solvente o de solución. En términos cuantitativos,
esto es, la relación o proporción matemática entre la cantidad de
soluto y la cantidad de solvente o, entre soluto y solución. Para expresar con exactitud la
concentración de las soluciones se usan sistemas como los siguientes:
a)Porcentaje
peso a peso (% M/M):
Relaciona la masa del soluto, en gramos, presente en una cantidad dada de solución. Teniendo en
cuenta que el resultado se expresa como porcentaje de soluto, la cantidad patrón de solución suele
tomarse como 100 g, es decir, indica el peso de soluto por cada 100 unidades de peso de la solución.
La siguiente expresión resume estos conceptos:
Relaciona la masa del soluto, en gramos, presente en una cantidad dada de solución. Teniendo en
cuenta que el resultado se expresa como porcentaje de soluto, la cantidad patrón de solución suele
tomarse como 100 g, es decir, indica el peso de soluto por cada 100 unidades de peso de la solución.
La siguiente expresión resume estos conceptos:
Por ejemplo, si se disuelven 10 g de NaCl en 90 g de agua, ¿cuál es el
porcentaje en masa de la sal?
Primero se calcula la masa de la solución:
10 g de NaCl 1 90 g de agua 5 100 g de solución.
Luego remplazamos en la fórmula:
b) Porcentaje
volumen a volumen (% V/V): se refiere al volumen de soluto, en
mL, presente en cada 100 mL de solución.es decir el volumen de soluto por cada
100 unidades de volumen de la solución.
La expresión que utilizamos para calcularlo es:
La expresión que utilizamos para calcularlo es:
Por ejemplo, ¿cuántos ml de ácido sulfúrico (H2
SO4
) hay en 300 mL
de una solución al 20% en volumen?
Una solución al 20% de H2
SO4
signifi ca que, por cada 100 mL de
solución se tienen 20 mL de H2
SO4
. Por tanto, si tenemos 300 mL de
solución tendremos 60 mL de H2
SO4
, según la siguiente operación:
c) Porcentaje
peso a volumen (% P/V): Representa la masa de soluto (en g) por
cada 100 mL de solución. Se puede calcular según la expresión:
Por ejemplo, ¿cuál es el porcentaje p/v de una solución que contiene
20 gramos de KOH en 250 mL de solución?
La información anterior nos indica que 250 mL de solución contienen
20 g de KOH. Por tanto, en 100 mL de solución habrá:
De donde, se obtiene que la cantidad de KOH presente equivale al 8%.
Solución normal o normalidad (N)
Son soluciones que contienen un equivalente químico del soluto en un volumen de 1000ml (1 L)
El equivalente químico (Eq) se calcula dividiendo el peso molecular (Ma) del soluto expresado en
gramos para la valencia.
Relaciona el número de equivalentes gramo o equivalentes
químicos de un soluto con la cantidad de solución, en litros. Se
expresa como:
El concepto de equivalente gramo o equivalente químico ha sido desarrollado
especialmente para referirse a ácidos y bases.
Así, un equivalente gramo es la masa de sustancia (ácido o base) capaz de producir un mol de iones H1 o OH2, según el caso. Para pasar de moles a gramos se emplean las masas moleculares de las sustancias involucradas.
Por ejemplo, un mol de HCl, cuyo peso molecular es 36,5 g, se ioniza para producir un mol de H1, por tanto, el peso de un equivalente gramo (abreviado peqg) de HCl es 36,5 g. En el caso de ácidos o bases que generan más de un mol de OH2 o H1, como por ejemplo, el H2 SO4 o el Al(OH)3 , el peso de un equivalentegramo se calcula así:
En cuanto al hidróxido de aluminio, 1 peqg es igual a 26 g, que es la tercera parte de su masa molecular. Dado que un ácido y una base reaccionan, a través de la neutralización mutua de los iones H1 y OH2, para producir las sales correspondientes y agua; el concepto de equivalente también se aplica para las sales.
Así, un equivalente gramo es la masa de sustancia (ácido o base) capaz de producir un mol de iones H1 o OH2, según el caso. Para pasar de moles a gramos se emplean las masas moleculares de las sustancias involucradas.
Por ejemplo, un mol de HCl, cuyo peso molecular es 36,5 g, se ioniza para producir un mol de H1, por tanto, el peso de un equivalente gramo (abreviado peqg) de HCl es 36,5 g. En el caso de ácidos o bases que generan más de un mol de OH2 o H1, como por ejemplo, el H2 SO4 o el Al(OH)3 , el peso de un equivalentegramo se calcula así:
En cuanto al hidróxido de aluminio, 1 peqg es igual a 26 g, que es la tercera parte de su masa molecular. Dado que un ácido y una base reaccionan, a través de la neutralización mutua de los iones H1 y OH2, para producir las sales correspondientes y agua; el concepto de equivalente también se aplica para las sales.
Solución Molar o Molaridad (M)
Es la forma más usual de expresar la concentración de
una solución. Se define como el número de moles de soluto disueltos
en un litro de solución. Alternativamente, se puede expresar como
milimoles de soluto disueltos en mL de solución.
Matemáticamente
se expresa así:
A diferencia de la normalidad, en
la molaridad no se divide para la valencia.
Se
derivan las siguientes fórmulas para este tipo de soluciones:
Pa= M x V x Ma M = Pa x 1000 ml
1000 ml V
x Ma
V=
Pa
x 1000 ml Ma = Pa x 1000 ml
M x Ma M
x V
Molalidad (m)
Indica la cantidad de moles de soluto presentes en un kg (1.000 g) de solvente. Cuando el solvente es agua, y debido a que la densidad de esta es 1 g/ml, 1 kg de agua equivale a un litro. La molalidad se calcula mediante la expresión:
Indica la cantidad de moles de soluto presentes en un kg (1.000 g) de solvente. Cuando el solvente es agua, y debido a que la densidad de esta es 1 g/ml, 1 kg de agua equivale a un litro. La molalidad se calcula mediante la expresión:
Pa m= Ma Pa=
m x Pb x Ma Pb (Kg)
Pb= peso del solvente en Kg
Fracción Molar (X)
expresa el número de moles de un componente de la solución, en relación con el número total de moles, incluyendo todos los componentes presentes.
Es una unidad química usada para expresar la concentración de soluto en solvente. Nos expresa la proporción en que se encuentran los moles de soluto con respecto a los moles totales de solución.
expresa el número de moles de un componente de la solución, en relación con el número total de moles, incluyendo todos los componentes presentes.
Es una unidad química usada para expresar la concentración de soluto en solvente. Nos expresa la proporción en que se encuentran los moles de soluto con respecto a los moles totales de solución.